La tabla periódica es conocida por todos, siendo utilizada en diversos lugares y ámbitos, estableciéndose como fundamental a la hora de entender sobre química. La misma se caracteriza por presentar a los distintos elementos químicos, los cuales se encuentran ordenados por su número atómico, configuración de electrones y propiedades químicas recurrentes, cuya estructura adoptada muestra tendencias periódicas.
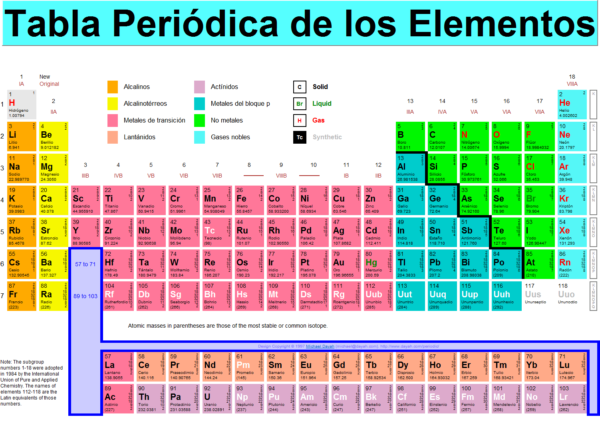
¿Qué es la Tabla Periódica de los elementos?
La tabla periódica de elementos organiza todos los elementos químicos conocidos en una matriz informativa. Los elementos se organizan de izquierda a derecha y de arriba a abajo en orden de aumentar el número atómico.
La idea de Mendeleev ha sido lentamente expandida y refinada con el descubrimiento o la síntesis de nuevos elementos adicionales.
Estructura de la Tabla Periódica de los elementos
Generalmente, dentro de una fila (período) los elementos son metales a la izquierda y no metales a la derecha, con los elementos que tienen comportamientos químicos similares que se colocan en la misma columna. Las filas de la tabla se denominan comúnmente períodos y las columnas se llaman grupos. Seis grupos han aceptado nombres así como números asignados: por ejemplo, los elementos del grupo 17 son halógenos; y el grupo 18 son gases nobles.
Es importante destacar que la organización de la tabla periódica se puede utilizar para derivar las relaciones entre las diversas propiedades de los elementos, pero también predice las propiedades químicas y los comportamientos de los elementos no descubiertos o recién sintetizados.
¿Cómo se agrupan los Elementos en la Tabla?
Grupos
Un grupo o familia es una columna vertical en la tabla periódica. Los grupos generalmente tienen tendencias periódicas más significativas que los períodos y bloques, que se explican a continuación. Las teorías mecánicas cuánticas modernas de la estructura atómica explican las tendencias grupales al proponer que los elementos dentro del mismo grupo generalmente tienen las mismas configuraciones de electrones en su capa de valencia. En consecuencia, los elementos en el mismo grupo tienden a tener una química compartida y exhiben una tendencia clara en las propiedades con un número atómico creciente.
En algunas partes de la tabla periódica, como el d-block y el f-block, las similitudes horizontales pueden ser tan importantes como, o más pronunciadas que, las similitudes verticales.
Según una convención de nomenclatura internacional, los grupos están numerados numéricamente del 1 al 18 desde la columna de la izquierda (los metales alcalinos) hasta la columna de la derecha (los gases nobles). Anteriormente, eran conocidos por números romanos. En América, los números romanos fueron seguidos por una «A» si el grupo estaba en el bloque s o p, o una «B» si el grupo estaba en el d-bloque. Los números romanos utilizados corresponden al último dígito de la convención de nomenclatura de hoy (por ejemplo, los elementos del grupo 4 eran del grupo IVB y los del grupo 14 eran del grupo IVA).
A algunos de estos grupos se les han dado nombres triviales (no sistemáticos), como se ve en la tabla a continuación, aunque algunos se usan raramente. Los grupos 3-10 no tienen nombres triviales y se mencionan simplemente por sus números de grupo o por el nombre del primer miembro de su grupo (como «el grupo scandium» para el grupo 3), ya que muestran menos similitudes y / o vertical tendencias
Periodos
Un período es una fila horizontal en la tabla periódica. Aunque los grupos generalmente tienen tendencias periódicas más significativas, hay regiones donde las tendencias horizontales son más significativas que las tendencias de grupos verticales, como el bloque f, donde los lantánidos y los actínidos forman dos series de elementos horizontales sustanciales.
Los elementos en el mismo período muestran tendencias en el radio atómico, la energía de ionización, la afinidad electrónica y la electronegatividad.
Yendo de izquierda a derecha en un período, el radio atómico por lo general disminuye. Esto ocurre porque cada elemento sucesivo tiene un protón y un electrón añadidos, lo que hace que el electrón se acerque más al núcleo.
Esta disminución en el radio atómico también hace que la energía de ionización aumente cuando se mueve de izquierda a derecha a lo largo de un período. Cuanto más unido esté un elemento, más energía se requiere para eliminar un electrón. La electronegatividad aumenta de la misma manera que la energía de ionización debido a la atracción ejercida sobre los electrones por el núcleo. La afinidad electrónica también muestra una ligera tendencia en un período.
Bloques
Las regiones específicas de la tabla periódica se pueden denominar bloques en reconocimiento de la secuencia en la que se rellenan las capas de electrones de los elementos. Cada bloque se nombra de acuerdo con la subshell en la que reside el «último» electrón. El bloque s comprende los primeros dos grupos (metales alcalinos y metales alcalinotérreos), así como hidrógeno y helio. El bloque p comprende los últimos seis grupos, que son los grupos 13 a 18 en la numeración de grupos IUPAC (3A a 8A en la numeración de grupos estadounidenses) y contiene, entre otros elementos, todos los metaloides.
Metales, metaloides y no metales
De acuerdo con sus propiedades físicas y químicas compartidas, los elementos se pueden clasificar en las principales categorías de metales, metaloides y no metales. Los metales generalmente son sólidos brillantes y altamente conductores que forman aleaciones entre sí y compuestos iónicos similares a sales con no metales (distintos de los gases nobles). La mayoría de los no metales son gases aislantes coloreados o incoloros; los no metales que forman compuestos con otros no metales presentan un enlace covalente.
Elementos de la Tabla Periódica
Se encuentran ordenados por número atómico. Esta lista contiene los 118 elementos que componen la tabla periódica.

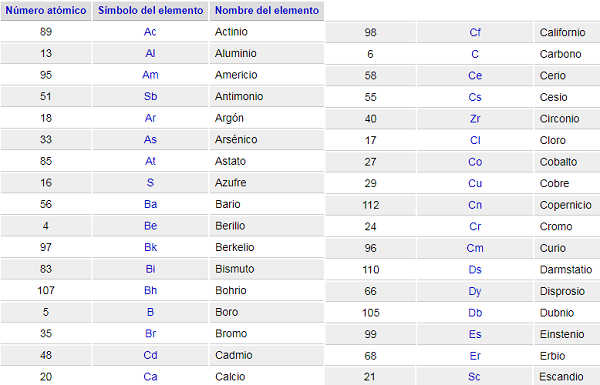
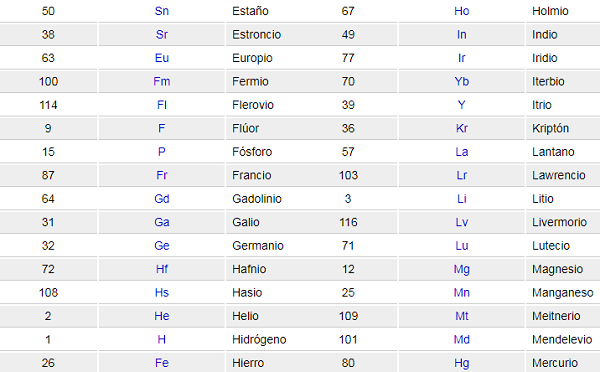

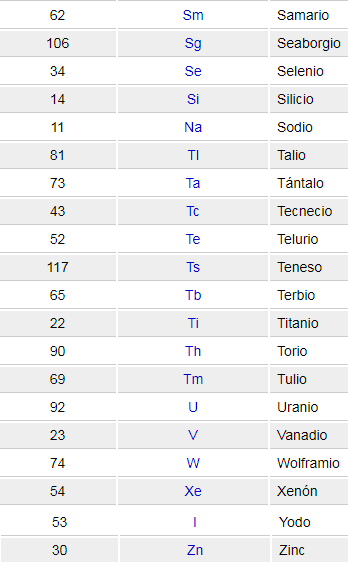
Para qué sirve cada elemento de la Tabla Periódica
La tabla periódica contiene una enorme cantidad de elementos importantes que brindan distinta información:
Número atómico: la cantidad de protones en un átomo se conoce como el número atómico de ese elemento. La cantidad de protones define qué elemento es y también determina el comportamiento químico del elemento. Por ejemplo, los átomos de carbono tienen seis protones, los átomos de hidrógeno tienen uno y los átomos de oxígeno tienen ocho.
Símbolo atómico: el símbolo atómico (o símbolo del elemento) es una abreviatura elegida para representar un elemento («C» para carbono, «H» para hidrógeno y «O» para oxígeno, etc.). Estos símbolos se usan internacionalmente y algunas veces son inesperados.
Peso atómico: el peso atómico estándar de un elemento es la masa promedio del elemento en unidades de masa atómica (amu). Los átomos individuales siempre tienen un número entero de unidades de masa atómica; sin embargo, la masa atómica en la tabla periódica se expresa como un número decimal porque es un promedio de los diversos isótopos de un elemento. La cantidad promedio de neutrones para un elemento se puede encontrar restando la cantidad de protones (número atómico) de la masa atómica.
Peso atómico para los elementos 93-118: Para los elementos naturales, el peso atómico se calcula a partir del promedio de los pesos de las abundancias naturales de los isótopos de ese elemento. Sin embargo, para los elementos trans-uranio creados en laboratorio, elementos con números atómicos superiores a 92, no existe una abundancia «natural». La convención es hacer una lista del peso atómico del isótopo más longevo en la tabla periódica. Estos pesos atómicos deberían considerarse provisionales ya que en el futuro podría producirse un nuevo isótopo con una vida media más larga.