En el post del día de hoy tenemos preparada una información muy útil, en especial para aquellos que tienen afinidad con la ciencia. Les daremos toda la información completa sobre el átomo y sus partes, podrán encontrar descripción que les será de ayuda tanto para los niños en la escuela como para trabajos más complejos en la universidad o en el trabajo.

¿Qué es un átomo?
Comenzaremos por definir al término átomo, éste significa indivisible, que algo no se puede dividir. Y, al hablar de ese término, estamos haciendo referencia a la unidad más pequeña de la materia con propiedades de un elemento químico. Todos los elementos, sean líquidos, gaseosos o plasmas, se componen de átomos neutros o ionizados.
Son partículas muy pequeñas, pero no tienen límites bien definidos en su estructura; es por eso que existen diferentes formas de medir su tamaño.
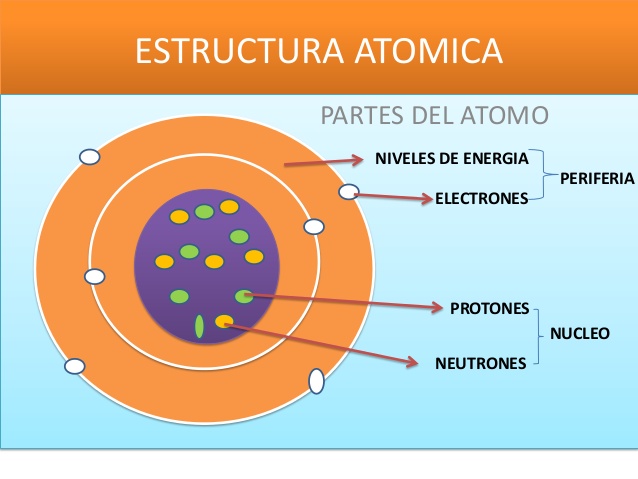
La estructura atómica podríamos clasificarla en tres partes: las partículas subatómicas, el núcleo atómico y los electrones.
Las partículas subatómicas
Lo que se conoce como partículas subatómicas hace referencia a los protones, neutrones y electrones. El electrón se caracteriza por ser la partícula más pesada del átomo y por tener carga negativa. Se la considera una partícula elemental ya que su magnitud se define como la carga eléctrica elemental.
Los llamados protones y neutrones, en cambio, no serían partículas elementales, sino que constituyen el llamado estado ligado de quarks u y d. Estos quarks se mantienen unidos mediante la fuerza nuclear fuerte.
Dentro del núcleo atómico encontramos a estos protones y neutrones, los cuales se ubican en la parte central. Los nucleones, a través de la fuerza nuclear, se mantienen unidos. Esto permite vencer la repulsión eléctrica entre los protones, debido a que la fuerza nuclear es mucho más intensa que la fuerza electromagnética a distancias cortas.
El núcleo atómico
El nucleo central suele ser muy denso y se constituye por protones, neutrones y electrones que se mantienen en constante movimiento alrededor del núcleo a una distancia significativa. Este núcleo atómico se puede alterar por algunos procesos energéticos que difieren de las reacciones químicas. Lo que puede ocurrir es que los nucleos inestables sufran desintegraciones que cambiarían el número de protones y neutrones que emitirían radiación. Los átomos de un mismo elemento mantienen los mismos números de protones, es el conocido número Z y se llama número atomico. Los isótopos son los elementos que tienen distintos número de neutrones.
Cuando hablamos de átomos con número atómico bajo, hablamos de núcleos con cantidades distintas de protones y neutrones que tienden a desintegrarse en núcleos con proporciones más estables.
Los electrones
Por último, los electrones son parte de esta estructura atómica. Éstos son atraidos por protones debido a la fuerza electromagnética. Tienden a formar una llamada onda estacionaria sobre este núcleo, las cuales se caracterizan por un orbital atómico: función que permite ubicar al electrón en el espacio. Cada uno de estos orbital corresponde a un valor de energía para los electrones que son repatidos entre ellos. En las líneas espectrales del átomo se pueden observar las energías proporcionadas por las diferencias entre los valores de los electrones.

Historia de la estructura atómica y sus partes
El primer modelo fue el llamado Modelo Atómico de John Dalton, a principios del siglo XIX, que tenía como hipótesis que los elementos nacían de una aglomeración de compuestos químicos. Este modelo destacaba la masa como la propiedad fundamental y se basó en ideas que iban más allá de la composición de los elementos.
Un científico británico llamado J.J Thompson protagonizó el segundo modelo: Modelo Atómico de John Thompson. Logró describir de forma clara la estructura del átomo, y descubrió que existía un orden en la combinación de los elementos. Relevó que existía el electrón y los rayos canales y positivos dentro de la estructura atómica.
El conocido Modelo Atómico de Ernest Rutherford fue creado en Nueva Zelanda por el científico Rutherford. Descubrió que los números atómicos tenían en su composición la misma cantidad de unidades de carga positiva como de electrones.
En 1913 un científico danés desarrolla el Modelo Atómico de Niels Bohr, el cual consideraba que los electrones se hallaban seperados en niveles o capas y que se ubicaban a gran distancia del núcleo atómico. La teoría se basa en que en estas capas se encuentra un determinado número de electrones, dos en la primera capa, ocho en la segunda, etc.
El Modelo Mecano-cuántico de Broglie fue creado por Luis de Broglie, un francés que propuso la idea de que cada electrón poseía dos tipos de conductas las cuales diferían en cuanto a la onda y el cuerpo.
Otro modelo fue el Modelo de Schrodinger, el cual deja atrás la concepción de que los electrones eran esferas con cargas que giran alrededor del núcleo atómico. El científico consideraba que los electrones se movían mediante la función «orbital»; esto ya aseguraba que se estaría en presencia de una zona delimitada del espacio.
Por último, el Modelo de Dirac, desarrollado en 1926 por el científico Paula Dirac. Este modelo permitió incorporar el espín del electrón y, a su vez, unió el trabajo de Werner Heisenberg con la propia, llamandola «ecuación de Dirac».
Principales propiedades del átomo
El tamaño de los átomos no están delimitados claramente, es por este motivo que se compara con el de nube electrónica. Lo que sí se puede medir es el llamado radio atómico, el cual se mide a partir de algún fenómeno físico.
Si se compara con elementos de la vida real, se puede decir que el grosor de un cabello humano es equivalente a un millón de átomos de carbono, lo cual permite vislumbrar su tamaño.
Lo que se conoce es que, las dimensiones del átomo, suelen ser miles de veces más pequeñas que la longitud de onda de la luz. Por este motivo no es posible observarlo mediante instrumentos óptimos.
Lo que se puede observar en la famosa tabla periódica de los elementos es que, el tamaño de los átomos, tiende a disminuir de una fila a otra para ir aumentando al comienzo de una nueva fila o periodo.
En cuanto a los Niveles de energía se conoce que la magnitud de la misma es la necesaria para desligarlo. Los que poseen grandes valores de energía se denominan estados excitados, y los que poseen el valor más bajo se denominan estado fundamental.
Lo que se denomina línea espectral es la transición entre una banda estrecha del espectro electromagnético y atraviesa una transición entre dos estados distintos.
Existe un fenómeno llamado efecto Stark o efecto Zeeman, el cual se refiere a los niveles de energía que son modificados por la interacción del electrón con este, modificando los niveles de energía.
Cada elemento químico se compone de las llamadas espectro de líneas. Constituyen, principalmente, la radiación de los átomos. Cuando los electrones excitados aparecen más tarde, lo que ocurre es que emiten en direcciones aleatorias, generando líneas de absorción oscuras. La composición de una sustancia es posible determinarla mediante las líneas de medidas espectroscópicas de la intensidad y anchura de ellas.
La Masa del átomo proviene de los nucleones, protones y neutrones del núcleo. Constituyen la masa de los electrones y la energía de ligadura de los nucleones, debido a la equivalencia existente entre masa y energía.